Dotychczasowe leczenie
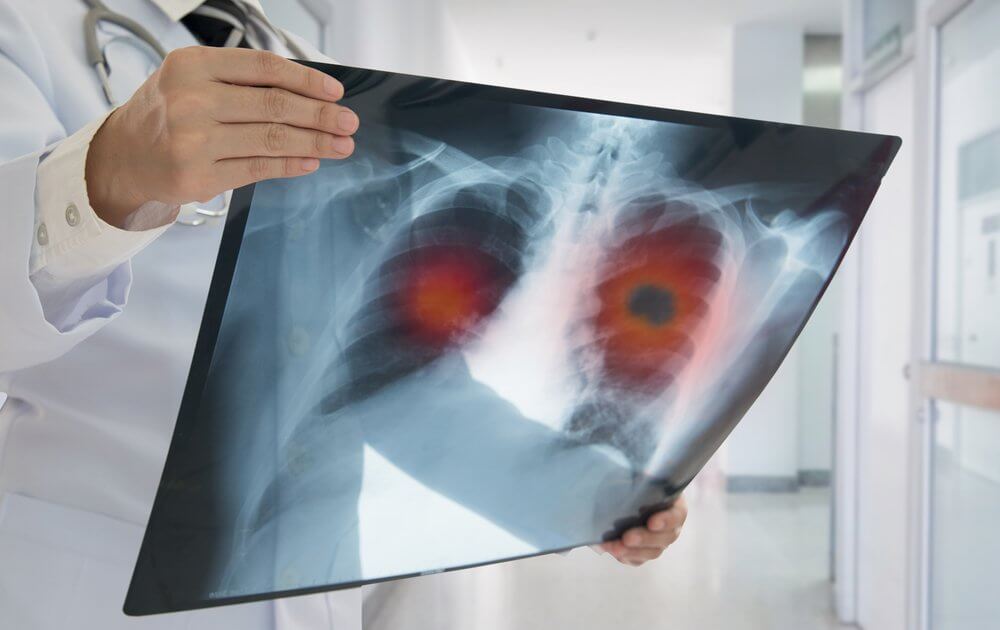
Rak płuc jest główną przyczyną zgonów zarówno wśród mężczyzn, jak i kobiet. Stanowi prawie 25% wszystkich zgonów z powodu raka. Obecnie dostępne terapie celowane, takie jak inhibitory kinazy tyrozynowej EGFR. Inhibitory te są niewrażliwe w leczeniu niedrobnokomórkowego raka płuc wywołanego mutacjami inercyjnymi egzonu 20. Nowotwór wywołany tą mutacją ma gorsze rokowanie w porównaniu z rakiem płuca wywołanym częstszymi mutacjami EGFR, takimi jak np. delecje egzonu 19 i substytucje L858R.
Czytaj również: Nowa strategia walki z rakiem szyjki macicy – Cemiplimab
Decyzja FDA
21 maja Janssen Pharmaceutical Companies of Johnson & Johnson ogłosiło, że FDA udzieliła przyspieszonej zgody na rejestrację Rybrevantu. Lek uzyskał zgodę w leczeniu dorosłych pacjentów z miejscowo zaawansowanym lub przerzutowym niedrobnokomórkowym rakiem płuca z mutacjami insercyjnymi 20 egzonu, u których choroba postępowała w trakcie lub po chemioterapii opartej na platynie. Rybrevant jest pierwszym w pełni ludzkim, bispecyficznym przeciwciałem zatwierdzonym do leczenia pacjentów cierpiących na ten rodzaj nowotworu. Lek wiąże się na zewnątrz komórki. Ponadto, hamuje wzrost guza i prowadzi do śmierci jego komórek. Przyspieszone zatwierdzenie przez FDA opiera się na pozytywnych wynikach pierwszej fazy wieloośrodkowego badania klinicznego. Badanie oceniało preparat w monoterapii u pacjentów włączonych do wcześniejszej chemioterapii platyną.
Czytaj również: Rak żołądka – FDA zatwierdza pierwszą immunoterapię
Szanse dla pacjentów
„Rak płuc to złożona choroba, a dzięki badaniom i głębszemu zrozumieniu zmian genetycznych, takich jak mutacje insercyjne w egzonie 20 EGFR, jesteśmy w stanie celować w tę chorobę w nowy sposób i poprawiać wyniki leczenia pacjentów” – powiedział badacz dr Joshua K. Sabari z New York University Langone’s Perlmutter Cancer Center. Przedstawił on najnowsze wyniki badań klinicznych na Światowej Konferencji Międzynarodowego Stowarzyszenia Badań nad Rakiem Płuc w Singapurze. Lek wprowadza nowe podejście terapeutyczne dla tej jednostki chorobowej. Staje się więc obietnicą dla osób chorych i ich rodzin.
Źródło: https://www.drugs.com/newdrugs/fda-approves-rybrevant-amivantamab-vmjw-first-targeted-patients-non-small-cell-lung-cancer-egfr-5525.html [dostęp: 09/06/2021]