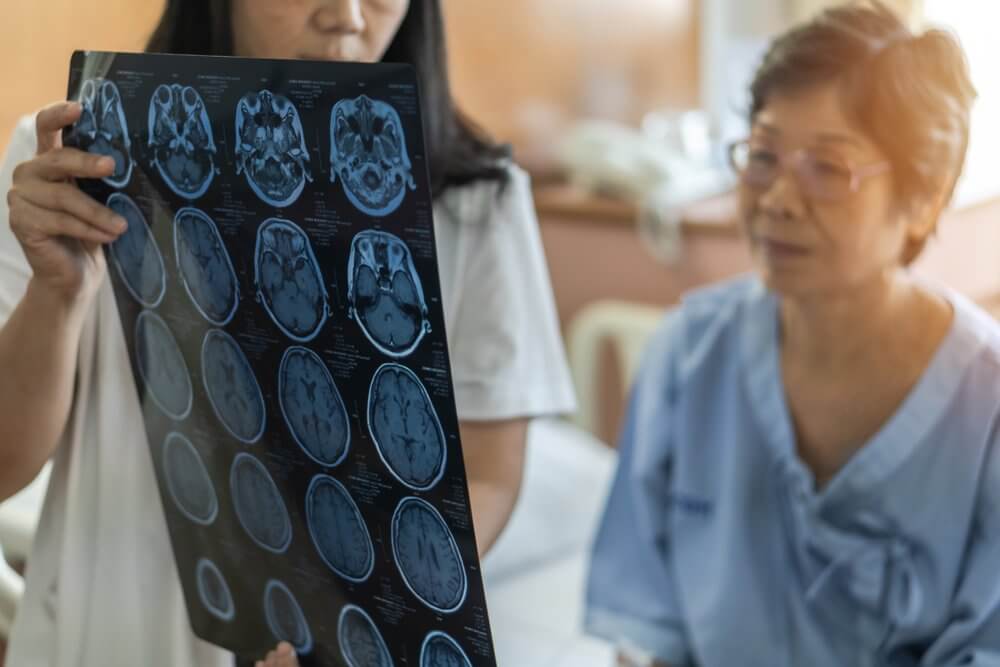
Endogenna substancja pożądana u pacjentów z udarem
Campbell wraz z zespołem badaczy przeprowadzili badanie 2 fazy w 12 ośrodkach w Australii. Celem badania była ocena bezpieczeństwa pierwszego rekombinowanego ludzkiego preparatu kalikreiny tkankowej (KLK1) – DM199. Do eksperymentu zakwalifikowano 92 pacjentów, których losowo przydzielono do DM199 lub placebo. Otrzymali oni początkowy wlew dożylny, a następnie wstrzyknięcie podskórne przypisanego leku w 1. dniu i kolejne wstrzyknięcia podskórne co 3 dni przez kolejne 22 dni. Głównym punktem końcowym było bezpieczeństwo mierzone częstością występowania poważnych zdarzeń niepożądanych.
Najczęstszymi zdarzeniami niepożądanymi były zaparcia, nudności i bóle głowy. Poważne zdarzenia niepożądane odnotowano u 43 % pacjentów leczonych DM199 i u 31 % pacjentów otrzymujących placebo. Badacze ocenili, że żadne poważne zdarzenie niepożądane u pacjentów przyjmujących DM199 nie było związane z leczeniem.
Działanie KLK1
Wyniki 2 fazy badania klinicznego ReMEDy sugerują, że rekombinowana formulacja ludzkiej kalikreiny tkankowej (KLK1) jest bezpieczna i dobrze tolerowana przez pacjentów z udarem niedokrwiennym. KLK1 jest endogenną wazoaktywną proteazą serynową oraz wazoregulatorem. Dane przedkliniczne pokazują, że substancja ma dwufazowy mechanizm działania w udarze – poprawia mikrokrążenie i zmniejsza stan zapalny, a także hamuje apoptozę neronów i przyspiesza ich odbudowę.
Dane dotyczące bezpieczeństwa pochodzące z badania ReMEDy „stanowią podstawę do opracowania na większą skalę i bardziej ostatecznych badań bezpieczeństwa i skuteczności tego nowego środka terapeutycznego” – powiedział Philip B. Gorelick, MD, MPH, adiunkt neurologii na Northwestern University Feinberg School of Medicine w Chicago, Illinois.
Odkrycia zostały zaprezentowane na Międzynarodowej Konferencji Udarowej (ISC) 2021.