Badania bezpieczeństwa i skuteczności
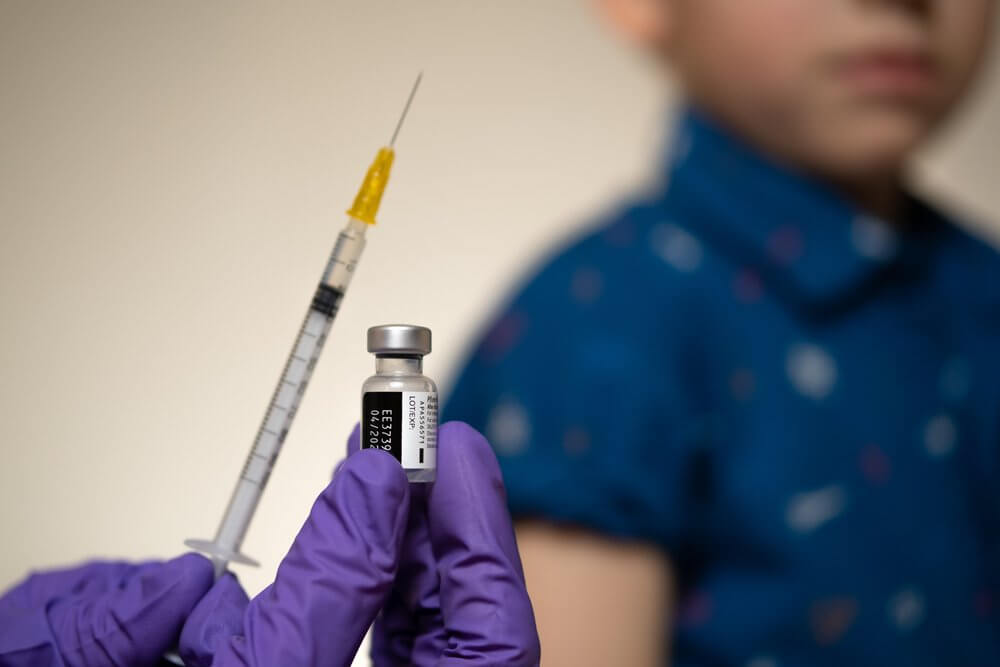
Dane dotyczące bezpieczeństwa stosowania szczepionki Comirnaty pochodzą z randomizowanego badania klinicznego z grupą kontrolną obejmującą 2660 osób w wieku 12-15 lat. Szczepionkę podano 1131 nastoletnim uczestnikom, a 1129 placebo z solą fizjologiczną. Ponad połowa uczestników była obserwowana pod kątem bezpieczeństwa przez co najmniej dwa miesiące po podaniu drugiej dawki. Działania niepożądane, które zgłaszano najczęściej to: ból w miejscu wstrzyknięcia, zmęczenie, ból głowy, dreszcze, ból mięśni, gorączka i ból stawów. Objawy te utrzymywały się zwykle od 1 do 3 dni. Występowały one częściej po podaniu drugiej dawki szczepionki.
Według analiz dotyczących skuteczności wykonanych szczepień, wśród 1005 osób zaszczepionych uczestników bez dowodów wcześniejszej infekcji SARS-CoV-2 nie wystąpiły przypadki COVID-19. Natomiast 16 przypadków COVID-19 wystąpiło wśród 978 osób, które otrzymały placebo. Obecnie dostępne są ograniczone dane dotyczące tego, czy szczepionka może zapobiec przenoszeniu wirusa. Ponadto w tej chwili nie są dostępne dane pozwalające określić, jak długo szczepionka zapewni ochronę.
Czytaj również: Szczepionki przeciwko COVID-19 — podział, mechanizmy działania i przechowywanie
Znaczenie decyzji FDA
Dzieci i młodzież z reguły przechodzą chorobę koronawirusową łagodniej niż osoby dorosłe, wskazuje się, że zatwierdzenie stosowania szczepionki w grupie wiekowej 12-15 lat jest ważnym krokiem na drodze do końca pandemii.
„Dzisiejsze działania pozwalają chronić młodszą populację przed COVID-19, przybliżając nas do powrotu do normalności i zakończenia pandemii. Rodzice i opiekunowie mogą być pewni, że agencja przeprowadziła rygorystyczny i dokładny przegląd wszystkich dostępnych danych, tak jak w przypadku wszystkich naszych zezwoleń na doraźne użycie szczepionek przeciw COVID-19” – powiedziała dr Janet Woodcock, która pełni obowiązki komisarza FDA.
Czytaj również: Niskie ryzyko wstrząsu po szczepieniu na COVID-19



![Ilustracja poradnika Koronawirus — podsumowanie tygodniowych danych epidemiologicznych [10.05-16.05]](https://demo.leki.pl/wp-content/uploads/2021/05/tygodnie-15.05-1-350x309.png.webp)



![Ilustracja poradnika Koronawirus — podsumowanie tygodniowych danych epidemiologicznych [08.03-14.03]](https://demo.leki.pl/wp-content/uploads/2021/03/20-1-350x297.png.webp)
![Ilustracja poradnika Koronawirus — podsumowanie tygodniowych danych epidemiologicznych [29.03-04.04]](https://demo.leki.pl/wp-content/uploads/2021/04/zmiany-03.04.21-1-350x259.png.webp)
